
(韩国庆尚大学)
最近,韩国庆尚大学研究人员发表的一篇综述再次推动了“肠-肠道微生物-脑“作用模式学说的发展,论文阐述了肠道微生物失调诱导的神经毒性机制可能会增加阿尔茨海默病(AD)和其他神经退行性疾病的易感性,而花青素可调节肠道代谢紊乱,应该给予特别关注!

今年4月1日刊登在《Cells》上的一篇文章“Gut Microbiota, Its Role in Induction of Alzheimer’s Disease Pathology, and Possible Therapeutic Interventions: Special Focus on Anthocyanins “再次为阿尔茨海默病的“脑肠轴”学说添了新证。
近期越来越多的研究提示肠道菌群与阿尔茨海默病(AD)发病过程关联。如早前来自波兰弗罗茨瓦夫医科大学的Karol Kowalski和Agata Mulak的一项研究就发现,肠道菌群作为大量淀粉样蛋白、脂多糖和其他毒素的来源,可能导致全身炎症反应和生理屏障的破坏。
肠道菌群的产物可以从胃肠道和口鼻腔转移到中枢神经系统,尤其是老年人。
肠道微生物可能刺激小胶质细胞,增强中枢神经系统的炎症反应,进而导致小胶质细胞功能受损,增加神经毒性和阻碍淀粉样蛋白的清除, 肠道菌群的组成调节可作为AD的潜在治疗靶点。
该篇综述论述了肠道微生物的组成和结构的改变可能通过释放炎性细胞因子和脂多糖、肠壁渗漏来促进肠道炎症发生,并可能影响对人体正常功能至关重要的全身炎症反应和免疫应答机制。
由这些微生物失调引起的神经毒性反应可能会增加阿尔茨海默病(AD)和其他神经退行性疾病的易感性。可以通过使用花青素等黄酮类化合物来调节肠道代谢紊乱。
该篇综述的主要论据有:
作者首先阐述了正常的肠道菌群在人体内的作用,肠道微生物可以制造产生很多的复合碳水化合物和短链脂肪酸(SCFAs),分别影响着不同的生理过程,如基因表达,细胞分化趋势和细胞增殖。
另外,SCFAs在调节免疫和炎症反应中发挥关键作用,如通过激活白介素IL-18的释放来检测细胞因子的释放。脂多糖是由肠道细菌在生态失调期间分泌,通过激活淀粉样蛋白信号通路,导致阿尔茨海默病的发生。
接着,作者论述了肠道菌群失调及其发病因素,包括很多影响因素,并详细阐述了各影响因素与肠道微生态的关系,且花青素可参与调节纠正这一失衡(图1)。

此前研究报道,细菌表面的脂多糖类可与星形胶质细胞受体(TLR2, TLR4, and CD14)结合,激活下游的核转录因子,诱导产生细胞炎症,进而发生神经炎症。这种神经炎症反应和反应小胶质细胞激活了多种阿尔茨海默病的途径,如BACE1通路(图2)。
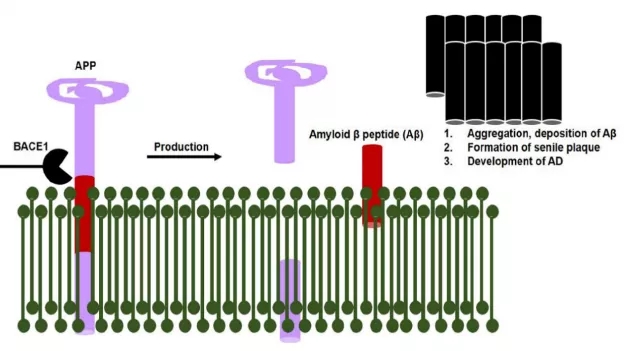
已有研究证明,有害细菌会产生各种毒素和多糖,而这些毒素和多糖又会导致肠壁发炎,引起肠道泄露。上皮细胞炎症还导致紧密连接蛋白的丢失,为未消化的食物颗粒、毒素和炎症细胞因子进入血液循环提供了机会。
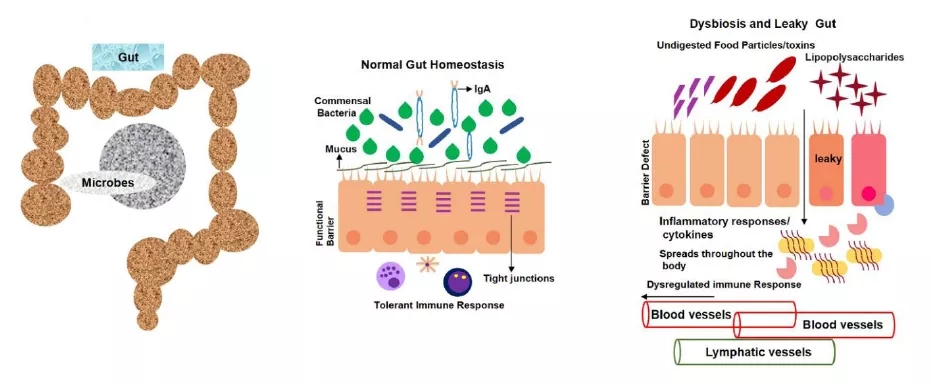
肠道泄露会增加循环炎性因子(LPS)和促炎细胞因子释放(图3)。含有毒素和脂多糖(LPS)的血液随后通过受损的血脑屏障进入大脑。
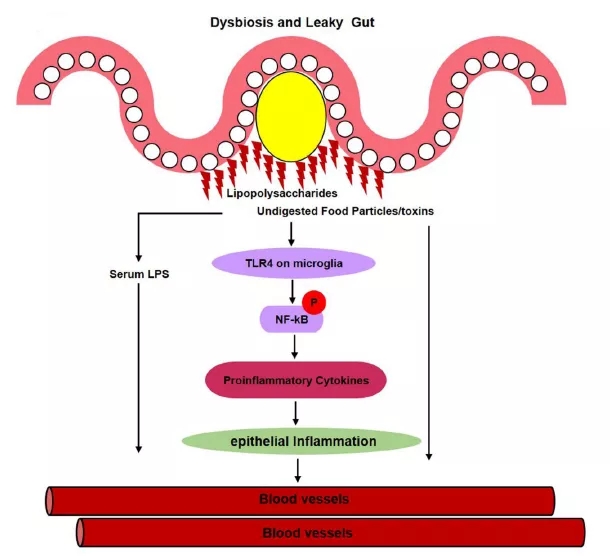
有害菌特别是革兰氏阴性菌分泌的脂多糖可以激活TLR4信号通路,并最终引起肠壁和肠壁上皮细胞炎症(图4)。
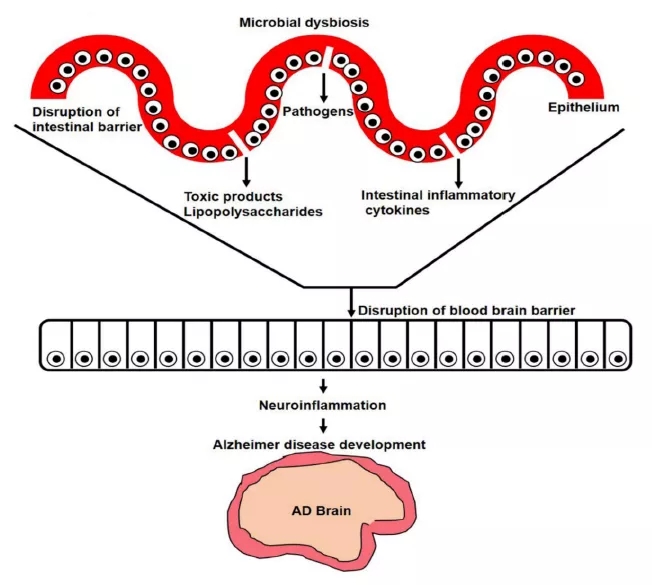
图 5 肠道微生物分泌的多糖和其他毒素会引起神经炎症
及阿尔茨海默病的发展
作者还总结了神经炎症介导的淀粉样蛋白负担和阿尔茨海默病的发病机理,认为在肠道微生态失衡条件下,循环炎性因子(LPS)主要在肠道内生成,随后通过血液进入大脑,导致神经炎症介导的淀粉样蛋白负担(图5)。
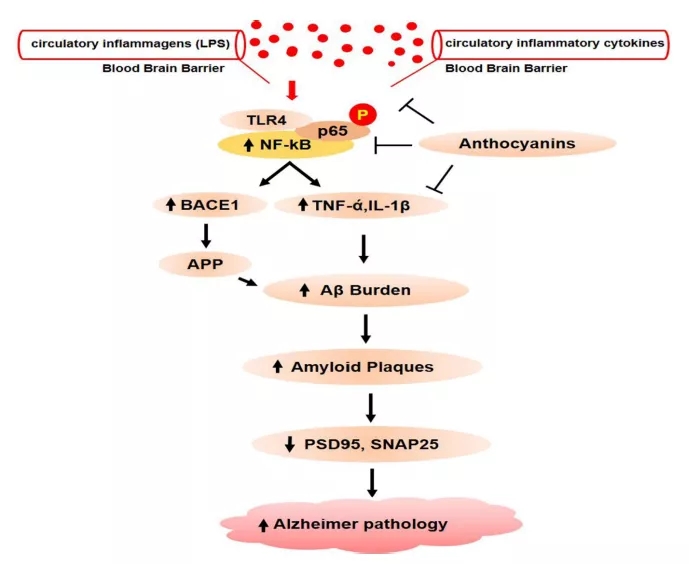
且有报道称,LPS是存在于小胶质细胞上的TLR4受体的配体。当LPS与TLR4结合时,通过下游NF-κB激活炎症级联反应。一旦NF-κB磷酸化与促炎细胞因子(TNF-α、IL-1、COX2)结合,就会增加神经炎症,而花青素对这一过程有抑制作用(图6)。
另外,Ali T和Khan, M.S等最近报道,花青素可以显著改善促炎细胞因子和ROS/JNK的表达,抑制神经炎症和阿尔茨海默病的病理进程。
由此看来,许多信号通路均参与了系统性炎症介导的神经炎症和阿尔茨海默病病理进程。
综上所述,该篇综述主要关注于TLR4/NF-κB、ROS/JNK和NF-κB/BACE1通路,并提出天然的多黄酮花青素可靶向作用于这些途径,不仅可以消除肠道菌群失调引起的炎症因子(LPS、促炎细胞因子、毒胺)介导的神经炎症和阿尔茨海默病的病理产物,也为花青素多靶点、多通路作用于阿尔茨海默病病理进程奠定了坚实的科学基础。
参考文献:
[1] Kowalski Karol,Mulak Agata,Brain-Gut-Microbiota Axis in Alzheimer's Disease.J Neurogastroenterol Motil, 2019, 25: 48-60.
[2] Musso, G.; Gambino, R.; Cassader, M. Obesity, diabetes, and gut microbiota: The hygiene hypothesis expanded? Diabetes Care 2010, 33, 2277–2284.
[3] Louis, P.; Hold, G.L.; Flint, H.J. The gut microbiota, bacterial metabolites and colorectal cancer.Nat. Rev. Microbiol. 2014, 12, 661–672.
[4] Correa-Oliveira, R.; Fachi, J.L.; Vieira, A.; Sato, F.T.; Vinolo, M.A. Regulation of immune cell function by short-chain fatty acids. Clin. Transl. Immunol. 2016, 5, e73.
[5] Macfarlane, S.; Macfarlane, G.T. Regulation of short-chain fatty acid production. Proc. Nutr. Soc. 2003, 62,67–72.
[6] Morrison, D.J.; Preston, T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes 2016, 7, 189–200.
[7] Louis, P.; Flint, H.J. Formation of propionate and butyrate by the human colonic microbiota. Environ. Microbiol.2017, 19, 29–41.
[8] Moos, W.H.; Faller, D.V.; Harpp, D.N.; Kanara, I.; Pernokas, J.; Powers, W.R.; Steliou, K. Microbiota and Neurological Disorders: A Gut Feeling. Biores. Open Access. 2016, 5, 137–145.
[9] Zhao, Y.; Jaber, V.; Lukiw,W.J. Secretory Products of the Human GI Tract Microbiome and Their Potential Impact on Alzheimer’s Disease (AD): Detection of Lipopolysaccharide (LPS) in AD Hippocampus. Front. Cell Infect. Microbiol. 2017, 7, 318.
[10] Zhan, X.; Stamova, B.; Jin, L.W.; DeCarli, C.; Phinney, B.; Sharp, F.R. Gram-negative bacterial molecules associate with Alzheimer disease pathology. Neurology 2016, 87, 2324–2332.
[11] Lukiw, W.J. Bacteroides fragilis Lipopolysaccharide and Inflammatory Signaling in Alzheimer’s Disease.Front. Microbiol. 2016, 7, 1544.
[12] Zhang,W.; Xu, J.H.; Yu, T.; Chen, Q.K. E ects of berberine and metformin on intestinal inflammation and gut microbiome composition in db/db mice. Biomed. Pharm. 2019, 118, 109131.
[13] Wisniewski, P.J.; Dowden, R.A.; Campbell, S.C. Role of Dietary Lipids in Modulating Inflammation through the Gut Microbiota. Nutrients 2019, 11, 117.
[14] Huang, H.Y.; Zhang, Z.J.; Cao, C.B.; Wang, N.; Liu, F.F.; Peng, J.Q.; Ren, X.J.; Qian, J. The TLR4/NF-kappaB signaling pathway mediates the growth of colon cancer. Eur. Rev. Med. Pharm. Sci. 2014, 18, 3834–3843.
[15] Giau,V.V.;Wu, S.Y.; Jamerlan, A.; An, S.S.A.; Kim, S.Y.; Hulme, J. Gut Microbiota and Their Neuroinflammatory Implications in Alzheimer’s Disease. Nutrients 2018, 10, 1765.
[16] Cerovic, M.; Forloni, G.; Balducci, C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front. Aging Neurosci. 2019, 11, 284.
[17] Khan, M.S.; Ali, T.; Kim, M.W.; Jo, M.H.; Jo, M.G.; Badshah, H.; Kim, M.O. Anthocyanins protect against LPS-induced oxidative stress-mediated neuroinflammation and neurodegeneration in the adult mouse cortex. Neurochem. Int. 2016, 100, 1–10.
[18] Ali, T.; Kim, T.; Rehman, S.U.; Khan, M.S.; Amin, F.U.; Khan, M.; Ikram, M.; Kim, M.O. Natural Dietary Supplementation of Anthocyanins via PI3K/Akt/Nrf2/HO-1 Pathways Mitigate Oxidative Stress,Neurodegeneration, and Memory Impairment in a Mouse Model of Alzheimer’s Disease. Mol. Neurobiol.2018, 55, 6076–6093.
[19] Pistollato, F.; Iglesias, R.C.; Ruiz, R.; Aparicio, S.; Crespo, J.; Lopez, L.D.; Manna, P.P.; Giampieri, F.; Battino, M.Nutritional patterns associated with the maintenance of neurocognitive functions and the risk of dementia and Alzheimer’s disease: A focus on human studies. Pharm. Res. 2018, 131, 32–43.
END
